强生将在单次疫苗研究的最后阶段招募60000名
芝加哥—强生(Johnson&Johnson)(J&J)已开始进行一次单剂疫苗的60,000人最终试验,与使用两剂的领先竞争对手相比,该疫苗有可能简化数百万剂的分配。
强生首席科学官保罗·斯托费尔斯博士在与美国国立卫生研究院和特朗普政府官员的联合新闻发布会上表示,该公司预计第三阶段试验将于年底或明年年初取得结果。
来自Moderna,Pfizer和AstraZeneca的竞争对手疫苗都需要两次注射,间隔数周,这使得它们更难以管理。
哈佛大学疫苗研究员丹·巴鲁什博士(Dan Barouch)表示:“单次注射疫苗的好处在大规模免疫运动和全球大流行控制方面具有潜在的深远意义。”

斯托弗尔斯说,强生公司将在其网站上发布有关其三期试验的详细研究方案,并与其他三家疫苗生产商一起,在呼吁提高试验的透明度之后,这些疫苗生产商已在最近几周内提供了这些研究计划。
斯托弗尔斯说,强生在美国和比利时的1和2期试验中看到了积极的结果后,便开始了3期试验。该公司计划立即发布这些结果。
Stoffels表示,该研究的安全性和保护水平与该公司动物研究中的水平相当,并表示结果表明,单剂量可以“长期”提供足够的保护。
强生的后期试验将在美国,南非,阿根廷,巴西,智利,哥伦比亚,墨西哥和秘鲁的多达215个地点使用。Stoffels说,该公司计划在2021年生产多达10亿剂,此后还会更多。
该试验的目的是测试该疫苗在单次使用后是否能预防中度至重度的当前局势,但也要看该疫苗是否可以预防需要医疗干预的严重疾病,以及是否可以预防较轻的疫苗。
Stoffels预测,要完全注册该试验将需要6周到2个月的时间,并表示该公司希望得到有关该疫苗是否“在年底或明年年初”起作用的答案。
目前尚不清楚该公司获得监管部门批准的速度如何,但强生计划在批准之前生产剂量,因此可以迅速开始分销。
独立监控
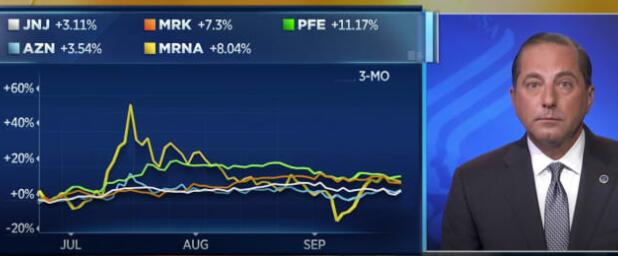
该试验将由独立的数据和安全监控委员会(DSMB)监督,该委员会将审查疫苗的安全性和有效性。在新闻发布会上,美国国立卫生研究院院长弗朗西斯·柯林斯博士说,所有三种疫苗均由美国联邦政府的“操作速度”组织和支持,强生,摩纳达和阿斯利康都共享一个DSMB。柯林斯说,辉瑞公司正在进行自己的试验,并有一个单独的DSMB。
强生的试验旨在测试一种有效率为60%的疫苗。在研究方案中,可以在154人感染该后确定。斯托弗尔斯说,公司将在接种疫苗15天后开始计算研究人群中感染的病例。
在感染20人后,DSMB将首先研究该疫苗的功效。
柯林斯说,DSMB不包括任何联邦雇员,由“非常有经验的”科学家和统计专家组成。
“直到他们确信存在某种看起来很有希望的东西,所有东西都不会被盲目发送给FDA。因此,每个人都应该放心。” Collins说。他发表上述评论之前,担心政府科学家可能会被迫敦促进行疫苗测试程序,以推动美国总统唐纳德·特朗普(Donald Trump)连任。