百健阿尔茨海默氏症药物与未来痴呆症治疗之战
FDA 批准Biogen的阿尔茨海默氏症药物 Aduhelm 是 Paul Aisen 博士生命中具有里程碑意义的时刻。南加州大学阿尔茨海默氏症治疗研究所所长在过去的三十年里一直专注于治疗神经退行性疾病,近年来帮助引导这种特殊药物通过临床试验的各个阶段。
但 6 月初,他坐在圣地亚哥阳光普照的办公室里,对美国食品和药物管理局 6 月初批准其“加速”使用的方式感到有些困惑,这通常只用于抗癌药物。这意味着它的临床益处被认为是可能的,但长期使用的批准将在第四阶段的试验中进行更广泛的研究。
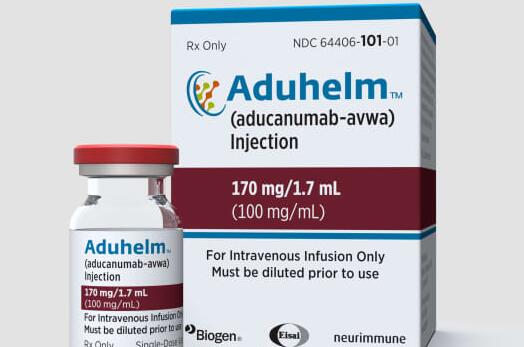
鉴于专家咨询委员会强烈公开反对批准,强调监管机构开绿灯的“不寻常性质”,作为百健 (Biogen) 付费顾问工作的艾森坚称,仍然存在“许多问题我有——还没有答案。”
自本周批准以来,FDA 监督研究小组的三名成员已经辞职,其中包括哈佛医学院医学教授 Aaron Kesselheim 博士,他在一封信中表示FDA对百健(Biogen)的决定“可能是美国最糟糕的药物批准决定”。最近的美国历史。”
去年 11 月,该小组以 8 比 1 的投票结果表示,百健 (Biogen) 的后期研究没有提供“强有力的证据”表明 aducanumab 有效治疗了阿尔茨海默氏症;另外两名小组成员表示,数据“不确定”。
虽然 Aisen 认为 Aduhelm 是一种对影响数百万美国人的疾病的“有效治疗方法”,但他也担心 FDA 的裁决对处于后期开发阶段的其他潜在治疗方案的影响。
他在最近的一次视频通话中表示,其他致力于更广泛阿尔茨海默氏症药物管道的团队面临的一个直接挑战是留住正在进行的试验的参与者,更不用说吸引新的参与者了。
“在大多数情况下,”他解释说,许多阿尔茨海默氏症患者会退出其他药物研究,转而使用新批准的 Aduhelm 进行治疗。他们的离开将使这些替代药物的试验数据变得不那么有用,尽管有朝一日可能会证明这些药物更安全、更有效或更适合疾病进展的不同阶段。但也许有悖常理的是,他仍然认为 Aduhelm 的批准是“对这些努力的推动——强大的推动力”。
超过 600 万美国人患有阿尔茨海默氏症
近年来,包括辉瑞和勃林格殷格翰在内的一些大型制药公司在 2018 年放弃了对脑部疾病的研究——事实上,百健在 2019 年的临床试验中曾一度放弃 Aduhelm,然后在数十年的失败后改变了决定。寻求突破。
围绕 Biogen 药物的争议(包括其潜在成本)与痴呆症治疗的巨大未满足需求以及每年花费美国高达 2590 亿美元的疾病相矛盾。根据阿尔茨海默氏症协会的估计,超过 600 万美国人患有阿尔茨海默氏症或其他形式的痴呆症,到2050 年,这一数字可能会超过 1200 万人,每年花费 1 万亿美元。
拉斯维加斯内华达大学神经病学家 Jeffrey Cummings 博士发表了一份年度审查报告,他表示,这就是为什么一些痴呆症药物专家将注意力集中在新的关注和新的融资上,而不是 Biogen 批准的潜在负面影响。阿尔茨海默氏症药物开发管道。他的研究始终显示,在 Biogen 批准之前,药物失败率为 99.6%,与成功的每 5 种抗癌药物中的 1 种 (20%) 形成鲜明对比。
卡明斯说,短期内其他药物试验的任何负面影响都将“被公司、风险投资和生物技术公司日益增加的兴趣所抵消,一旦他们看到有一种方法可以获得特定药物的批准。疾病。”
在最近的历史中,美国国立卫生研究院在心脏病和癌症研究上的花费是痴呆症的两到三倍,而缺乏合格的临床试验参与者也减缓了进展。
痴呆症药物管道中的下一个
对于少数其他希望清除这些相同监管障碍并证明其功效的其他发育性阿尔茨海默氏症药物——礼来的 donanemab、罗氏的 gantenerumab 和 Eisei 的 lecanemab——可能有一线希望将先发优势让给 Aduhelm。
经过数十年昂贵但迄今为止基本上没有结果的研究试验,制药巨头礼来 (Eli Lilly) 的首席执行官大卫·里克斯 (David Ricks) 表示,在其产品 donanemab 的第二阶段结果取得积极成果后,他的公司“越来越接近目标”。
今年 5 月,也就是 FDA 批准竞争对手 Biogen 的 Aduhelm 的一个月前,他在CNBC 的健康回报峰会上发表讲话说,他的团队“对成功的可能性感到满意”,并表示他也想探索一条“加速”路线,利用他的方法称“FDA 考虑更快查看数据的适应性途径”,“应该应用于像阿尔茨海默氏症这样的严重和广泛的疾病。”
然而,他承认下一阶段试验的招募需要更多的参与者,而且考虑到这将持续 18 个月,他预计最早在 2023 年底之前不会有新的获批产品。
几位专家告诉 CNBC,Biogen 药物具有独特的监管批准门槛,治疗潜力似乎胜过不确定的现实世界的好处,可能会重振礼来等竞争对手的努力,他们专注于开发依赖于相对相似技术的药物。
Aduhelm 自己的临床试验数据表明,该药物成功靶向并清除了许多研究人员认为导致阿尔茨海默氏症的特定类型蛋白质的簇。但它提供的证据不足以证明该药物为患者提供认知益处。
关于靶向β淀粉样蛋白形成的争论
科学家们将其称为 aducanumab,它通过提供一系列从白细胞中克隆的相同抗体来发挥作用。选择这些抗体是因为它们具有靶向能力,因为它们可以识别特定的蛋白质,称为 β 淀粉样蛋白,在体内构建了特定的结构。
南加州大学伦纳德·戴维斯的克里斯蒂安·派克表示,有大量证据表明,这些 β 淀粉样蛋白的形成,也称为“病理聚集体”或“斑块”,是阿尔茨海默病的主要驱动因素,尽管确切的因果机制仍未完全了解老年学学院。尽管如此,他说抗体可以帮助防止这些斑块形成,然后引导其他粒子将它们分开,这一过程在前后神经成像中可以清楚地识别。
打个比方,将 β 淀粉样蛋白视为年轻人在一天中在城市中行走可能会有所帮助,其中城市是人体,而一天是人类的寿命。在某些城市,随着下午变成晚上,个别年轻人开始聚集,其中一些聚集会变得有毒,并开始引起问题。Aduhelm 提供的抗体就像执法人员一样,到达现场,识别麻烦的集会,将他们包围,将他们分开,然后命令旁观者驱散年轻人。
“如果你说‘嘿嘿,FDA 正在接受这个一般概念,’”派克在电话中说,“如果我们能从受疾病影响的人的大脑中去除 β 淀粉样蛋白,即使证据有限认知益处,”他继续说道,“可能有多种不同的疗法符合这些类型的标准。”
过去针对 β 淀粉样蛋白的阿尔茨海默氏症管道中的一长串失败将继续给乐观情绪带来压力,直到产生确凿的证据——本周关于数十年来批准的第一种新的阿尔茨海默氏症药物的争议表明尚未完成。
南加州大学健康经济学家 Darius Lakdawalla 说:“我们将通过一种或另一种方式使用这种药物发现淀粉样蛋白清除假说是否正确,”他认为继续试用 Biogen 的药物将证明是有用的。到这种确认性的努力。
“如果它是正确的,那么我认为它为许多创新打开了大门,许多候选药物将在未来追求该假设时试图清除淀粉样蛋白。”